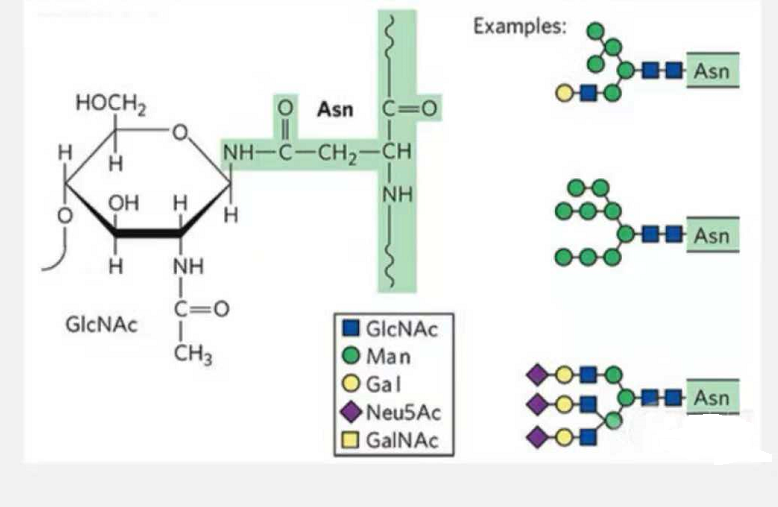
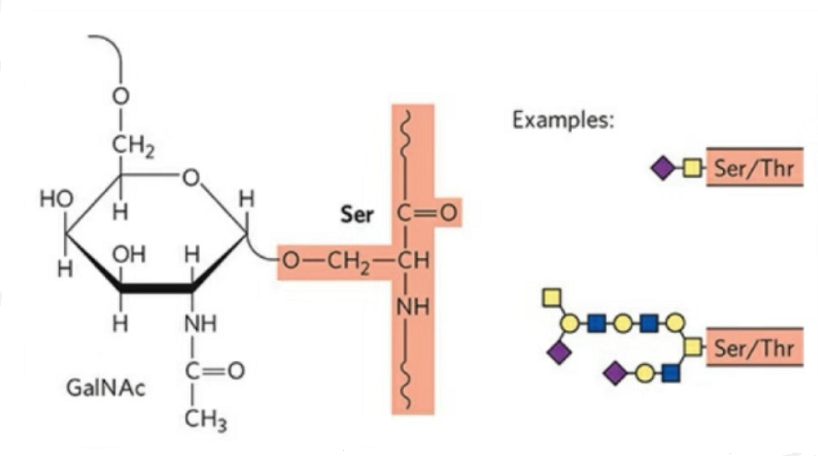
Volgens de verbindende manier van aminozuur en suiker kan suikerpeptide worden onderverdeeld in vier categorieën: O-glycosylatie, C a N-glycosylatie, dauwversuikering en GPI (glycofosfatidlyinositol) verbinding.
1. N-glycosylatie-glycopeptiden zijn samengesteld uit N-aceetamideglucose aan het reducerende uiteinde van de glycaanketen (Glc-Nac) gekoppeld aan het N-atoom op de amidegroep van de zijketen van sommige Asn in de peptideketen, en de Asn die in staat zijn de glycaanketen te verbinden, moeten zich bevinden in de AsN-X-Ser/Thr (X! =P) in het motief gevormd door de residuen.De suiker is N-acetylglucosamine.
N-glycosylatie gemodificeerd structureel glycopeptide
2. De structuur van O-glycosylatie is eenvoudiger dan N-glycosylatie.Dit glycopeptide is over het algemeen korter dan de glycaan, maar kent meer typen dan N-glycosylering.Ser en Thr kunnen in het algemeen in de peptideketen worden geglycosyleerd.Daarnaast zijn er glycopeptiden versierd met tyrosine-, hydroxyl- en hydroxyproline-glycosylatie.De schakelpositie is het hydroxylzuurstofatoom op de zijketen van het residu.De gekoppelde suikers zijn galactose of N-acetylgalactosamine (Gal&GalNAc) of glucose/glucosamine (Glc/GlcNAc), mannose/mannosamine (Man/ManNAc), enz.
O-glycosylering wijzigt de structuur
3. Glycopeptide O-GlcNAC-glycosylatie ((N-acetylcysteïne (NAC)) (glcnAcN-acetylglucosamine/acetylglucosamine)
Een enkele N-acetylglucosamine (GlcNAc) glycosylering verbindt eiwitten O-GlcNAc met het hydroxylzuurstofatoom van de serine- of threoninerest van een eiwit.O-GlcNA-glycosylatie is een O-GlcNAc monosacharide-ornament zonder glycaanextensie;Net als peptidefosforylering is O-GlcNAc-glycosylatie van glycopeptiden ook een dynamisch eiwitdecoratieproces.Abnormale O-GlcNAc-decoratie kan een verscheidenheid aan ziekten veroorzaken, zoals diabetes, hart- en vaatziekten, tumoren, de ziekte van Alzheimer enzovoort.
Glycosyleringspunten van glycopeptiden
De basisstructuren van polypeptide- en suikerketens zijn door covalente bindingen aan eiwitketens gekoppeld, en de plaatsen die de suikerketens met elkaar verbinden worden glycosylatieplaatsen genoemd.Omdat er geen sjabloon is om de biosynthese van glycopeptide-suikerketens te volgen, zullen verschillende suikerketens aan dezelfde glycosyleringsplaats worden gehecht, wat leidt tot de zogenaamde microscopische inhomogeniteit.
Glycosylering van glycopeptiden
1. Effect van glycopeptideglycosylering op de therapie-effectiviteit van therapeutische eiwitten
In het geval van therapietherapeutische eiwitten beïnvloedt glycosylering ook de halfwaardetijd en de doelgerichtheid van eiwitgeneesmiddelen in vivo
2. Oplosbare glycopeptide-glycosylatie en eiwitten
Studies hebben aangetoond dat suikerketens op het oppervlak van eiwitten de moleculaire oplosbaarheid van eiwitten kunnen verbeteren
3. Glycopeptideglycosylatie en immunogeniciteit van eiwitten
Enerzijds kunnen suikerketens op het oppervlak van eiwitten specifieke immuunreacties veroorzaken.Aan de andere kant kunnen suikerketens bepaalde oppervlakken op het eiwitoppervlak bedekken en de immunogeniciteit ervan verminderen
4. Glycopeptideglycosylatie die de eiwitstabiliteit verhoogt
Glycosylering kan de stabiliteit van eiwitten onder verschillende denaturatieomstandigheden (zoals denatureringsmiddelen, hitte, enz.) verhogen en de aggregatie van eiwitten voorkomen.Tegelijkertijd kunnen de suikerketens op het oppervlak van eiwitten ook enkele proteolytische afbraakpunten van eiwitmoleculen bedekken, waardoor de weerstand van eiwitten tegen proteïnasen toeneemt.
5. Glycopeptideglycosylering die de biologische activiteit van eiwitmoleculen beïnvloedt
Veranderende eiwitglycosylatie kan er ook voor zorgen dat eiwitmoleculen nieuwe biologische activiteiten vormen
Posttijd: 03-aug-2023