Fluorescentie-resonantie-energieoverdracht (FRET)
Fluorescentie-resonantie-energieoverdracht (FRET) is een niet-stralingsenergieoverdrachtsproces waarbij de energie van de donor-aangeslagen toestand wordt overgedragen naar de aangeslagen acceptor-toestand door de interactie van intermoleculaire elektrische koppels.Bij dit proces zijn geen fotonen betrokken en is het daarom niet-stralend.Deze test heeft de voordelen dat hij snel, gevoelig en eenvoudig is.
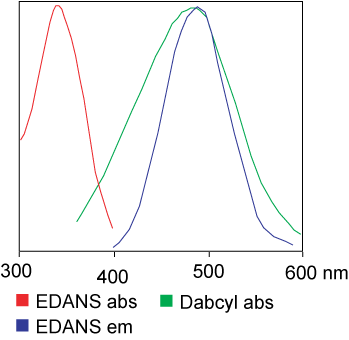
De kleurstof die in de FRET-test wordt gebruikt, kan identiek zijn.Maar bij de meeste toepassingen worden eigenlijk verschillende kleurstoffen gebruikt.Kort gezegd is de overdracht van lichtresonantie-energie de overdracht van een paar dipolen van de donor (kleurstof 1) naar de acceptor (kleurstof 2) wanneer de donorgroep opgewonden is.Over het algemeen overlapt het emissiespectrum van de donorfluorofoorgroep het absorptiespectrum van de acceptorgroep.“Wanneer de afstand tussen de twee fluoroforen geschikt is (10 – 100 A), kan de overdracht van fluorofoorenergie van de donor naar de acceptor worden waargenomen.”De methode van energieoverdracht hangt af van de chemische structuur van de receptor:
1. Wordt omgezet in moleculaire trillingen, dat wil zeggen dat het lichtgevende licht van energieoverdracht verdwijnt.(De receptor is een lichtblusser)
2. De emissie is intenser dan de receptor zelf, wat resulteert in een roodverschuiving in het secundaire fluorescentiespectrum.”(Receptoren zijn lichtgevende emitters).
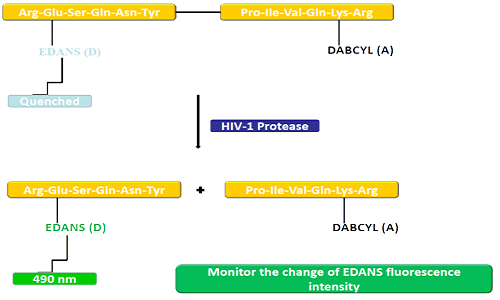
De donorgroep (EDANS) en het acceptorgen (DABCYL) zijn uniform gekoppeld aan het natuurlijke substraat van HIV-protease, en wanneer het substraat niet wordt losgekoppeld, kan DABCYL EDANS doven en vervolgens niet meer detecteerbaar worden voor fluor.Na ontkoppeling van HIV-1-protease wordt EDANS niet langer gedoofd door DABCYL en kunnen EDANS-luciferasen vervolgens worden gedetecteerd.De beschikbaarheid van proteaseremmers kan worden gevolgd door veranderingen in de fluorescentie-intensiteit van EDANS.
FRET-peptiden zijn handige hulpmiddelen om de niet-specificiteit van peptidase te bestuderen.Omdat het reactieproces continu kan worden gevolgd, biedt het een handige methode voor het detecteren van enzymactiviteit.De glans die wordt geproduceerd na de hydrolyse van peptidebindingen door de donor/acceptor geeft een maatstaf voor de enzymactiviteit bij nanomolaire concentraties.Wanneer het FRET-peptide intact is, vertoont het een plotselinge verdwijning van de interne flits, maar wanneer een peptidebinding tegenover de donor/acceptor verbreekt, geeft het een flits vrij, die continu kan worden gedetecteerd en de enzymactiviteit vervolgens kan worden gekwantificeerd.
Posttijd: 14 augustus 2023